Statystyki - luty
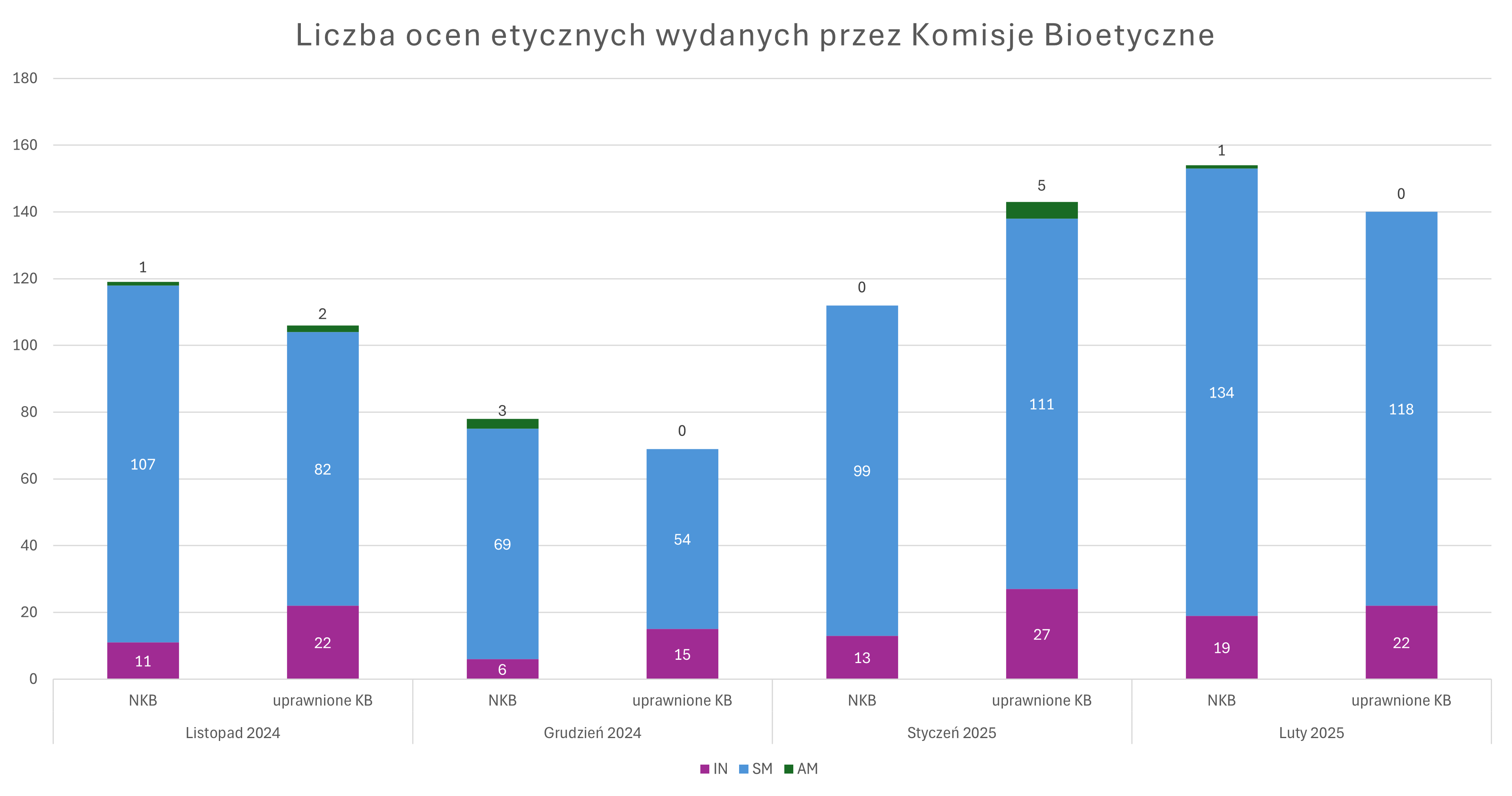
Wykres przedstawia liczbę ocen etycznych wydanych przez zespoły opiniujące Naczelnej Komisji Bioetycznej oraz uprawnionych Komisji Bioetycznych w czterech następujących po sobie miesiącach.
Od dnia 31 stycznia 2025 r. badania kliniczne produktów leczniczych stosowanych u ludzi zatwierdzone na mocy dyrektywy 2001/20/WE w sprawie badań klinicznych (CTD), będące w toku, musiały zostać dostosowane do wymagań rozporządzenia w sprawie badań klinicznych (CTR) oraz wprowadzone do Clinical Trials Information System (CTIS).
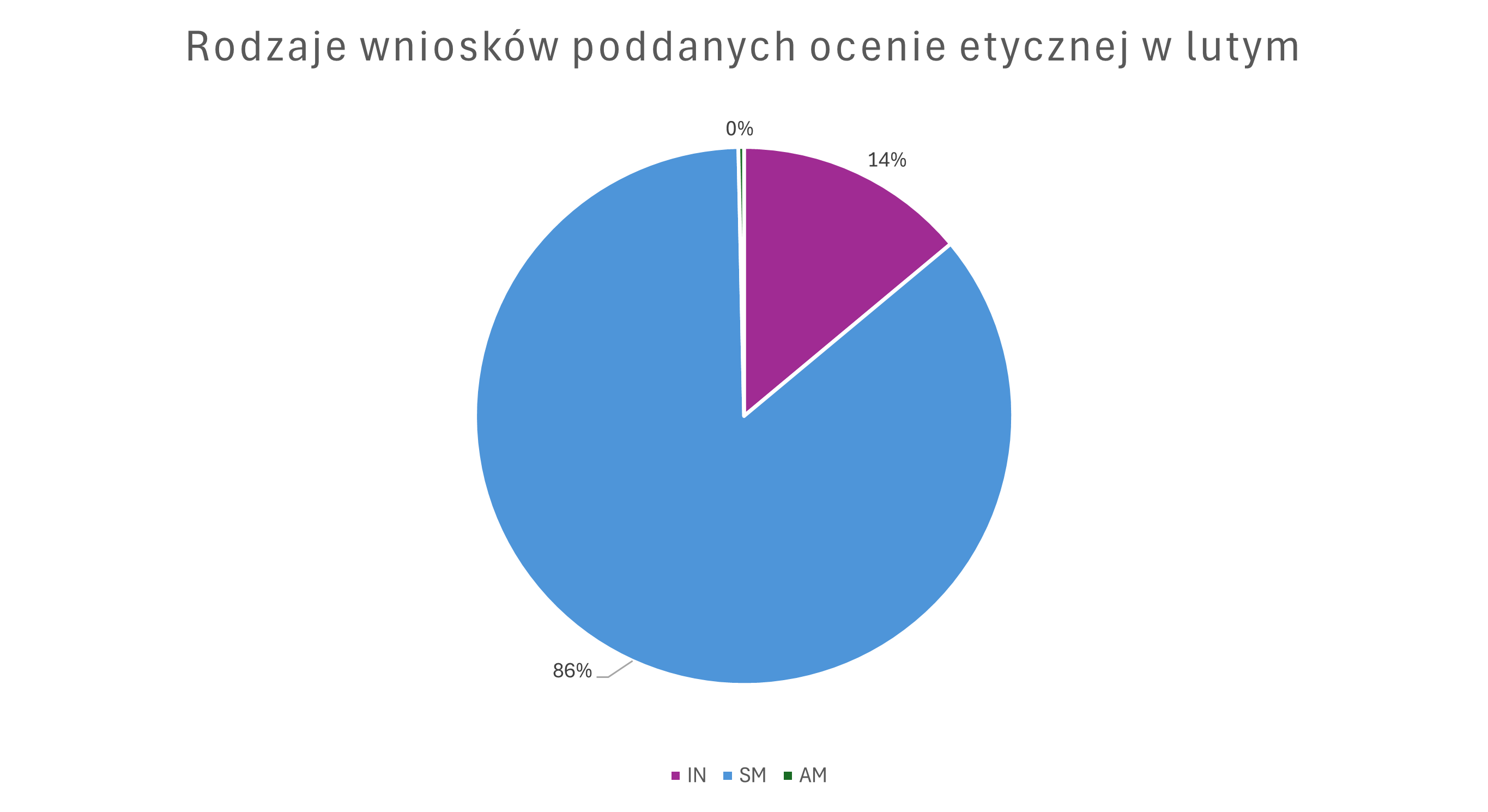
W lutym zopiniowane wnioski o istotną zmianę w badaniu klinicznym stanowiły 86% wszystkich wniosków poddanych ocenie. Wnioski inicjalne stanowiły 14% zaś pozostały odsetek dotyczył dodania Polski do już toczącego się w innych krajach badania klinicznego.
LEGENDA
IN - wniosek inicjalny, wniosek o wydanie pozwolenia na prowadzenie nowego badania klinicznego produktu leczniczego
SM - wniosek o pozwolenie na wprowadzenie zmian w badaniu klinicznym produktu leczniczego
AM - wniosek o dodanie zainteresowanego państwa członkowskiego, składany w przypadku rozszerzania badania, na które sponsor otrzymał pozwolenie, na dodatkowe państwo
Od 31 stycznia 2025 r. wszystkie wnioski o badania kliniczne są prowadzone w systemie informacji o badaniach klinicznych (ang. Clinical Trials Information System, CTIS).